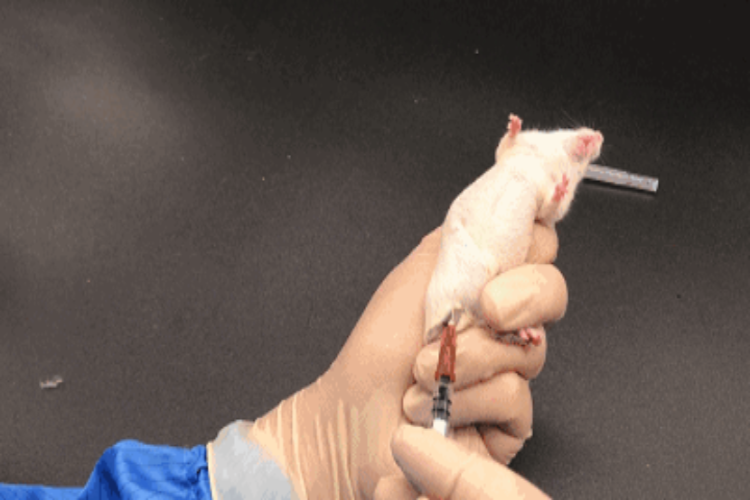
急性全身毒性试验介绍
急性全身毒性试验是在24h内一次、多次或连续接触试验样品后在任何时间内发生的不良反应。急性全身毒性提供根据预期临床途径进行的急性接触所产生的健康危害方面的基本信息。急性全身毒性试验可作为亚急性/亚慢性和其他试验确定剂量接触方式的初试步骤,并且可提供物质预期临床接触途径毒性作用模式方面的信息。
急性全身毒性实验动物
急性全身毒性试验的典型试验是采用啮齿类动物(大鼠、小鼠),一般情况下,宜使用已知来源并符合规定微生物健康状况的健康、初成年的饲育动物。在研究的开始阶段,同一性别的动物体重差异应不超过平均值的士20%,如使用雌性动物,宜未育并无孕。对动物选择应进行论证。
急性全身毒性试验步骤
试验前先将小鼠标记并称重,随机分为SC、CSO试验组和SC、CSO介质对照组(若试验样品采用原液注射方法,则分为试验组与SC对照组),每组5只小鼠。根据试验样品的临床使用方法确定接触途径,一般来说,SC试验液和SC介质对照液采用尾静脉注射法(IV),CSO试验液和CSO介质对照液采用腹腔注射法(IP)。若试验样品为口腔器械产品或材料,则SC试验液、SC介质对照液、CSO试验液、CSO介质对照液均采用经口灌胃的方式给予试验动物。每只小鼠所给予的最大剂量为50ml/kg。
注射后立即观察小鼠所有行为表现,然后分别在注射后4h、24h、48h、72h继续观察小鼠行为表现及有无动物死亡,并在24h、48h、72h记录动物的体重。若有必要延长试验周期,需要在第一次接触后,每周称重一次,并在试验终结时测量体重,且需每天观察。
急性全身毒性试验结果判定
药典方法试验结果判定和评价
1. 在急性全身毒性试验观察期间,如接触试验样品的动物生物学反应不大于介质对照组动物,则试验样品符合试验要求。
2. 采用5只动物,如2只或2只以上出现死亡,或2只或2只以上出现抽搐或俯卧,或3只或3只以上出现体重下降超过10%,则试验样品不符合试验要求。
3. 如试验组动物仅显示轻微生物学反应,且不多于1只动物出现一般生物学反应症状或死亡,应采用10只动物为试验组重复进行试验。
4. 重复试验时,如全部10只接触试验样品的动物在观察阶段未显示出大于介质对照组动物科学意义上的生物学反应,则试验样品符合试验要求。
非药典方法试验结果判定和评价
若试验中小鼠出现临床症状,则需对小鼠进行解剖及病理学检查。
1. 判断复试 试验组5只动物仅显示轻微生物学反应,且不多于1只动物出现一般生物学反应症状或死亡,应采用10 只动物重复试验。
2. 判断合格 试验过程中,如果试验组5只动物生物学反应不大于介质对照组动物,则试验样品符合试验要求;或者重复试验时,试验组10 只动物生物学反应不大于介质对照组动物,则试验样品符合试验要求。
3. 判断不合格 试验组5只动物中,如2只或2只以上出现死亡,或2只或2只以上出现抽搐或俯卧,或3只或3只以上出现体重下降超过10%,则试验样品不符合试验要求。
急性全身毒性试验标准
GB/T 16886.11-2011 医疗器械生物学评价第11部分:全身毒性试验
ISO 10993-11:2017 医疗器械生物学评价第11部分:全身毒性试验
GB/T 14233.2-2005医用输液、输血注射器具检验方法第2部分:生物试验方法
GB/T 16175-2008医用有机硅材料生物学评价试验方法
GB/T16886.12-2017/ISO 10993-12:2012医疗器械生物学评价第12部分:样品制备与参照材料
急性全身毒性试验送样要求
1提取物: 120 cm² < 0.5mm厚,60 cm² ≥ 0.5 mm厚,或4g
2提取物: 240 cm² < 0.5mm厚,120 cm² ≥ 0.5 mm厚,或8g
3提取物: 360 cm² < 0.5mm厚,180 cm² ≥ 0.5 mm厚,或12g
4提取物: 480 cm² < 0.5 mm厚,240 cm² ≥ 0.5 mm厚,或16g
5直接暴露:最少10 mL


 电话:400-133-6008
电话:400-133-6008 地址:广州市天河区兴科路368号(天河实验室)
地址:广州市天河区兴科路368号(天河实验室)
广州市黄埔区科学城莲花砚路8号(黄埔实验室) 邮箱:atc@gic.ac.cn
邮箱:atc@gic.ac.cn




























 立即咨询
立即咨询 留言咨询
留言咨询